Des scientifiques russes auraient trouvé un moyen pour créer un dispositif quantique, son coefficient d’efficacité étant presque de 100 %.
Ceci leur permettra de contrecarrer au deuxième principe de la thermodynamique, principe considéré comme une règle inviolable.
Rappel sur le deuxième principe de la thermodynamique
Le deuxième principe de la thermodynamique (également connu sous le nom de deuxième loi de la thermodynamique ou principe de Carnot) établit l'irréversibilité des phénomènes physiques, en particulier lors des échanges thermiques.
C'est un principe d'évolution qui fut énoncé pour la première fois par Sadi Carnot en 1824.

Sadi Carnot (physicien)
Nicolas Léonard Sadi Carnot, né le 1er juin 1796 à Paris et mort le 24 août 1832 à Ivry-sur-Seine ou à Paris, usuellement appelé Sadi Carnot, est un physicien et ingénieur français. À l’instar de Copernic, il ne publia qu’un seul livre, les Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance (Paris, 1824), dans lequel il exprima, à l’âge de 27 ans, ce qui s’avéra être le travail de sa vie.
Énoncé de la loi
Toute transformation d'un système thermodynamique s'effectue avec augmentation de l'entropie globale incluant l'entropie du système et du milieu extérieur.
On dit alors qu'il y a création d'entropie.
La fonction d'état entropie : S, a été considérée comme une mesure du désordre.
Il existe, pour toute transformation thermodynamique, évoluant d'un état initial I à un état final F, une fonction d'état extensive S appelée fonction entropie.
Pour une transformation finie, la variation d'entropie DS du système est la somme de deux termes :
DS = SF - SI = DeS + DiS
DeS est l'entropie d'échange ou entropie de
transfert : c'est la variation d'entropie due aux échanges de chaleur entre le système et le milieu extérieur.
DiS est l'entropie interne ou entropie créée au sein du système.
DeS et DiS dépendent de la nature de la transformation.
Pour une variation élémentaire :
dS = deS + diS
dS est une différentielle exacte, deS et diS, ne le sont en général pas.
Dans le cas d'une transformation réversible, la création globale d'entropie est nulle.
Remarques
L'entropie d'un système isolé ne peut qu'augmenter ou rester constante puisqu'il n'y a pas d'échange de chaleur avec le milieu extérieur.
L'entropie d'un système peut diminuer mais cela signifie que l'entropie du milieu extérieur augmente de façon plus importante ; le bilan entropique étant positif, ou nul si la transformation est réversible.
L'expression « degré de désordre du système » introduite par Boltzmann peut se révéler ambigüe et subjective. En effet on peut aussi définir l'entropie comme une mesure de l'homogénéité du système considéré.
L'entropie d'un système thermique est maximale quand la température est identique en tout point.
De même, si on verse un liquide colorant dans un verre d'eau, l'entropie du système coloré sera maximale quand, à la suite du mélange, la couleur du contenu sera devenue uniforme.
Tout système isolé, siège d'une agitation aléatoire, tend spontanément à s'homogénéiser de manière irréversible ce qui intuitivement semble contraire à une augmentation du désordre.
Le second principe est un principe d'évolution qui stipule que toute transformation réelle s'effectue avec création d'entropie.
Signification de l'Entropie
L'entropie est une mesure du désordre : la création d'entropie correspond à l'accroissement du désordre microscopique du système.
On en déduit que si on passe d'un état ordonné à un état désordonné, l'entropie augmente, ce qui est le cas du passage de l'état solide à l'état liquide, et de l'état liquide à l'état gazeux.
De même, l'entropie d'un corps augmente donc lorsque l'agitation moléculaire augmente, c'est-à-dire lorsque la température s'élève (à pression constante).
Exemples
L'énergie s'écoule toujours de la haute intensité vers la basse intensité par un transfert d'extensité.
La boîte de Maxwell
Soit une boîte circulaire plate, horizontale, partagée par une cloison en deux compartiments égaux, et contenant N palets blancs et N palets noirs, de même rayon r, glissant sans frottements sur le fond. Ouvrir un passage dans la cloison, d'une grandeur supérieure à 2r, pour permettre le passage des palets. Secouer, puis immobiliser la boîte. Il est assez intuitif que l'état le plus souvent réalisé se rapprochera de N/2 palets blancs et N/2 palets noirs dans chaque compartiment mais avec d'immenses fluctuations, d'autant plus grandes en valeur absolue que la boîte sera grande et que N sera grand. Ces fluctuations croissent en effet comme {\sqrt {N)). Mais plus N est grand, plus ces fluctuations seront négligeables devant N et la répartition se rapprochera de N/2 pour chaque couleur de palet dans chaque compartiment. On remarque ici un autre aspect du second principe qui montre que l'évolution spontanée d'un système va, pour une échelle d'observation donnée (car ce qui semble homogène à une échelle peut ne toujours pas l'être à une autre très inférieure), toujours vers l'homogénéité.
Piston dans un cylindre hermétique
Imaginons un cylindre creux fermé hermétiquement aux deux extrémités. Imaginons aussi un piston libre de se déplacer dans ce cylindre. Si l'on déplace le piston vers la gauche, la partie gauche voit sa pression augmenter et son volume diminuer et, vice-versa, la partie droite voit sa pression chuter et son volume augmenter. Si l'on relâche le piston, il va spontanément se déplacer vers la droite, vers sa position d'équilibre initiale. Le déplacement se fait donc de la partie à haute pression, qui voit son volume augmenter, vers la partie à basse pression qui voit son volume chuter
Le "Théorème de récurrence " de Poincaré qui veut contre-dire le second principe de la Thermodynamique
Le théorème de récurrence de Poincaré dit que,
"pour presque toutes les « conditions initiales », un système dynamique conservatif dont l'espace des phases est de « volume » fini va repasser au cours du temps aussi près que l'on veut de sa condition initiale, et ce de façon répétée."
Ce « théorème de récurrence » s'oppose donc au second principe, car il implique que toute évolution macroscopique est réversible.
Un retour a l'état initial est donc théoriquement possible ,
MAIS
Boltzmann calcula le temps nécessaire à 100 cm3 de gaz pour revenir à son état initial. Il trouva 10 puissance 10 de puissance 10 années !!!
Evolution récente avec la physique quantique
Un groupe de physiciens russes de l'Institut de physique et de technologie de Moscou (MFTI) essaye de passer outre le deuxième principe de la thermodynamique grâce à la création d'un nouveau dispositif quantique dont le coefficient énergétique serait pratiquement de 100 %.
Normalement, le coefficient énergétique des moteurs thermiques n'atteint jamais ce chiffre : le réfrigérateur, moteur de refroidissement, réduit inévitablement l'entropie et le gaspillage de l'énergie thermique, explique Andreï Lebedev, collaborateur à École polytechnique fédérale de Zurich (ETH) et au MFTI.
L'année dernière, une équipe de scientifiques, dirigée par Gordey Lesovik de l'Institut Landau de physique théorique, a découvert qu'il était possible de violer le deuxième principe de la thermodynamique.
Ce principe établit , comme vous le savez, l'irréversibilité des phénomènes physiques dans le monde, étant ainsi inviolable a priori.
Cette découverte a permis aux physiciens de créer un analogue quantique du démon de Maxwell, créature hypothétique qui range les molécules lentes et rapides.
Mais qu'est ce que le Démon de Maxwell ?
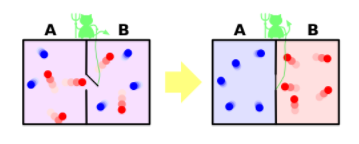
L'expérience du démon de Maxwell consiste en une boîte contenant un gaz, à deux compartiments (A et B) séparés par une porte P à l'échelle moléculaire ;
un « démon » commande la porte.
Le fonctionnement de la porte ne dépense pas d'énergie.
Maxwell suppose, comme on commençait à l'admettre à l'époque, que le gaz est constitué de molécules en mouvement.
Le démon est capable de déterminer la vitesse des molécules, et commande l'ouverture ou la fermeture de la porte en fonction de l'état des molécules.
À partir de là, l'expérience a plusieurs variantes.
Dans sa version originale, la température est supérieure dans le compartiment B à ce qu'elle est dans le compartiment A. Or la température est proportionnelle à la vitesse quadratique moyenne des molécules. Le démon laisse passer du compartiment B au compartiment A les molécules de B plus lentes que la vitesse moyenne des molécules du compartiment A, et laisse passer de A à B les molécules de A plus rapides que la vitesse moyenne des molécules dans B.
Résultat : la température dans B a augmenté tandis que celle de A est réduite : on a donc refroidi une source froide à partir d'une source chaude, ce que la seconde loi de la thermodynamique a justement pour objet d'interdire.
On diminue donc l'entropie totale du système.
Dans une variante, le démon ouvre la porte aux molécules qui veulent entrer dans le premier compartiment (A), mais il ferme la porte à celles qui veulent sortir. Ainsi, les molécules passent spontanément, sans travail, de B vers A. Le démon augmente l'énergie à l'intérieur du compartiment A et la diminue dans le compartiment B : il serait dès lors possible en utilisant l'information que possède le démon (la reconnaissance des molécules et le tri sur cette base) de transformer de l'énergie cinétique d'agitation thermique en travail.
Les deux situations sont équivalentes, puisque le passage de la situation finale de la première expérience à celle de la deuxième est aisé.

Les chercheurs Russes ont compris qu'il était possible d'utiliser ces « démons » quantiques afin de créer un nouveau dispositif au coefficient énergétique de 100 %.
En réalité, ce dispositif n'est certainement pas « un mouvement perpétuel », comme l'explique M. Lesovik, puisqu'il faut constamment renouveler les qubits « diaboliques » qui purifient le système de l'entropie en les refroidissant.
De l'autre côté, on le fait en dehors du « mouvement », ce qui permet de dire que « formellement » le deuxième principe de la thermodynamique est violé en son intérieur.
Actuellement, M. Lesovik et ses collègues travaillent afin de réaliser cette idée dans la pratique en créant un « mouvement perpétuel » sur la base de qubits supraconducteurs, qui sont des transmons.


Écrire commentaire