
À la découverte des origines de la vie ?
Une équipe internationale a détecté de l’acide carbonique dans l’espace interstellaire, ce qui pourrait bouleverser les théories sur les éléments constitutifs de la vie.
En examinant le nuage moléculaire G+0.693-0.027 près du centre de notre galaxie, l’équipe a découvert de l’acide carbonique.
Auparavant, seuls l’acide acétique et l’acide formique, deux acides carboxyliques comme l’acide carbonique, avaient été trouvés dans des étendues aussi vastes.
Leur présence dans l’espace lointain renforce les théories selon lesquelles la Terre aurait reçu ces éléments de météorites ou de comètes.
Le rôle de l’acide carbonique sur Terre
Sur notre planète, l’acide carbonique résulte de la dissolution du CO2 dans l’eau, ce qui donne ce goût acidulé aux boissons gazeuses. Il est alarmant de constater qu’il provoque également l’acidification de nos océans à mesure que les niveaux de CO2 atmosphérique augmentent.
Bien que des observations d’acide carbonique aient été faites sur des corps célestes tels que les lunes de Jupiter et même Mars, sa détection dans l’espace lointain est une première. Cela implique l’existence d’un milieu interstellaire complexe, qui pourrait regorger de composés liés aux acides aminés. La recherche d’autres acides, dont le glycolique et la glycine, semble désormais plus prometteuse.
Il est intéressant de noter que le caractère insaisissable de l’acide carbonique dans l’espace, malgré son abondance possible, peut être attribué à son invisibilité pour les observations radioastronomiques.
Quelques notions de chimie du carbone inorganique dans l'eau et le captage du CO2
Un premier niveau de captage du CO2 qui agit sur terre et dans l'océan est celui de la photosynthèse qui transforme le Cinorg du CO2 en Corg et qui s'exprime par l'équation suivante:

Un second niveau très important est la dissolution du CO2 dans l'océan. Quand le CO2 est dissout dans l'eau, qu'elle soit douce (terrestre) ou salée (océans), de l'acide carbonique se forme:
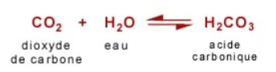
Cet acide carbonique se dissocie en libérant ses atomes d'hydrogène. Quand son premier atome est libéré, il se forme un ion bicarbonate:

Le pH de l'eau contrôle cette réaction. Si la concentration en H+ diminue, ce qui correspond à une augmentation de pH, le rééquilibrage de l'équation entraîne une réaction vers la droite et une plus grande quantité d'acide carbonique se dissocie. À l'inverse, une augmentation de la concentration en H+ (soit une diminution du pH) entraîne une réaction vers la gauche et forme H2CO3 au détriment de HCO3-.
Quand le second atome d'hydrogène de l'acide carbonique est libéré, le bicarbonate HCO3- se transforme en carbonate CO32- selon:

Pour une concentration en H+ donnée, c'est-à-dire à un pH de l'eau donné, les quantités relatives d'ions carbonates et bicarbonates s'ajustent jusqu'à l'atteinte de l'équilibre. Un pH supérieur à 7 (on rappellera que 7 est le pH neutre), favorise la production des ions carbonates, alors qu'un pH inférieur à 7 favorise les ions bicarbonates.
De manière générale, les eaux marines sont alcalines (pH > 7) et les eaux douces continentales sont acides (pH < 7).
La perturbation de cet équilibre, par exemple par la diffusion de CO2 anthropique de l'atmosphère vers l'océan, changera le pH de l'eau marine. Un changement de pH affectera les concentrations relatives de l'acide carbonique H2CO3, des ions bicarbonates HCO3- et des ions carbonates CO32- de la façon suivante:
la dissolution du CO2 forme de l'acide carbonique (réaction 2), et la dissociation de l'acide carbonique produit des ions bicarbonates et hydrogènes (réaction 3), la production de ces derniers entraînant un abaissement de pH. Les ions hydrogènes réagissent alors avec les ions carbonates pour former d'autres ions bicarbonates (inverse de la réaction 4, c'est-à-dire réaction vers la gauche). La réaction chimique exprimant le captage d'un excès de CO2 par l'océan est la somme de ces trois réactions, soit:


Écrire commentaire